结直肠癌(CRC)是全qiu第三大常见癌症,约 30%-40% 的患者会发生肝转移(CRLM),而免疫治疗在 CRLM 患者中疗效有限 —— 核心症结在于肿瘤微环境(TME)的免疫抑制特性。近日《Cancer Research》发表重磅研究,首ci系统揭示SPP1 通过激活 CAFs(癌相关成纤维细胞)的 CXCL12 分泌,驱动 CRLM 及免疫治疗耐药的分子机制,为精准靶向治疗提供了新方向。
在这项高质量研究中,Absin 的 基质胶(货号:abs9490)作为关键实验材料,全程支持了盲肠原位肝转移模型的构建,为模拟临床真实转移场景、验证治疗效果提供了可靠的体外 / 体内微环境基础。
文献标题:SPP1 Drives Colorectal Cancer Liver Metastasis and Immunotherapy Resistance by Stimulating CXCL12 Production in Cancer-Associated Fibroblasts
发表期刊:Cancer Research(IF 16.6)
DOI:https:/ /doi.org/10.1158/0008-5472.CAN-24-4916
核心试剂:基质胶(标准型,含酚红)(abs9490)


研究团队以 “破解 CRLM 免疫耐药" 为目标,设计了 “筛选 - 验证 - 机制 - 靶向" 四步走的研究方案,逻辑清晰且环环相扣:
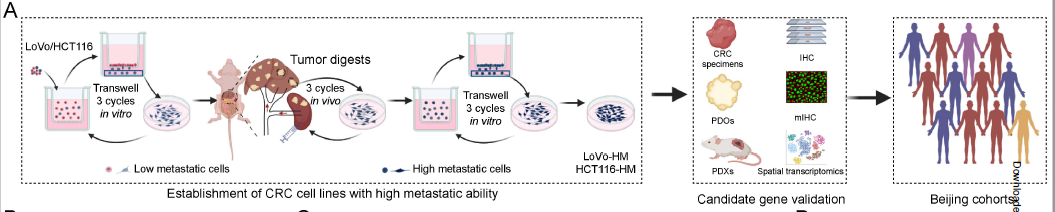
原文 Fig. 1A:高转移细胞系构建与研究设计框架
筛选关键驱动因子:
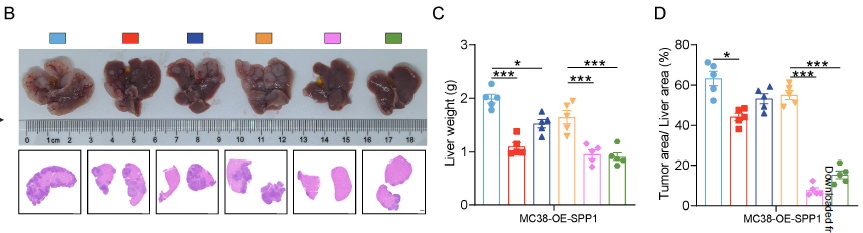
通过 “体外 Transwell 筛选 + 体内脾注射转移模型",建立高肝转移潜能细胞系(LoVo-HM/HCT116-HM);结合空间转录组、单细胞测序及 GEO 数据库(GSE41568 等)交叉分析,发现SPP1 是唯yi在 CRLM 中持续上调的基因。
验证 SPP1 的功能:
体内外实验证实:过表达 SPP1 显著增强 CRC 细胞迁移 / 侵袭能力,促进肝转移灶形成;且 SPP1 高表达与 CRLM 患者免疫治疗耐药、CD8+T 细胞浸润减少密切相关。
解析分子机制:
聚焦 TME 中的 CAFs(最丰fu的基质细胞),发现 SPP1 通过与 CAFs 表面 CD44 结合,激活 β-catenin/HIF-1α 信号通路,促进 CAFs 分泌 CXCL12;CXCL12 一方面通过 EMT 促进 CRC 转移,另一方面抑制 CD8+T 细胞浸润,形成 “转移 - 耐药" 恶性循环。
验证靶向治疗策略:
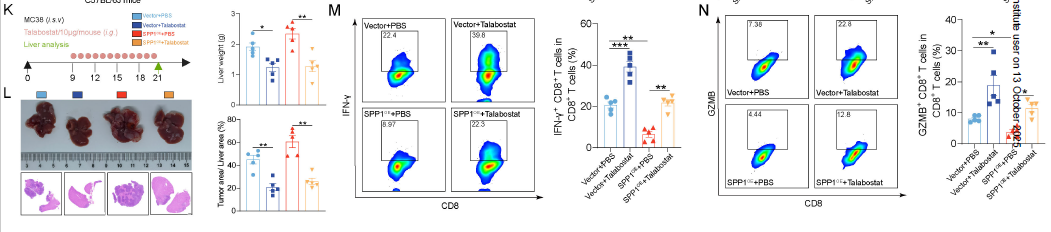
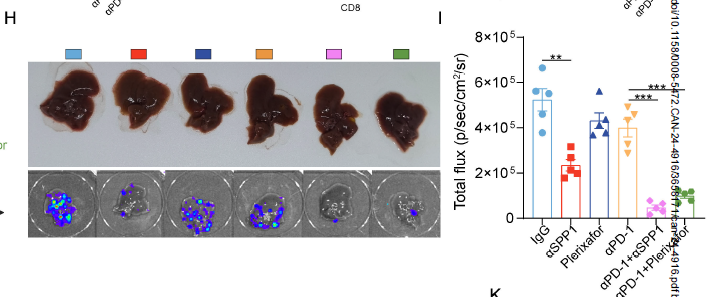
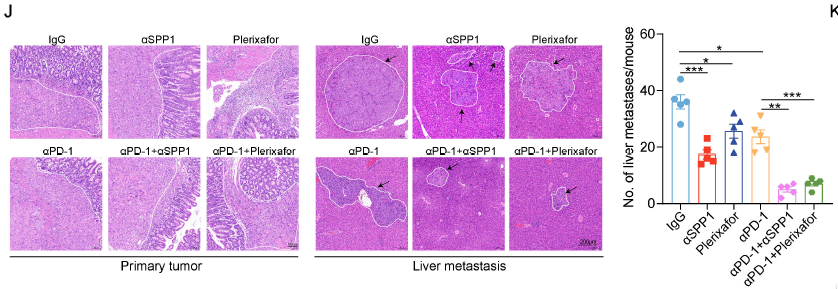
体内实验证实:抗 SPP1 抗体、CXCR4 拮抗剂(plerixafor)或 CAFs 抑制剂(talabostat),可显著恢复 CD8+T 细胞浸润,增强抗 PD-1 治疗效果。
锁定关键驱动基因 SPP1
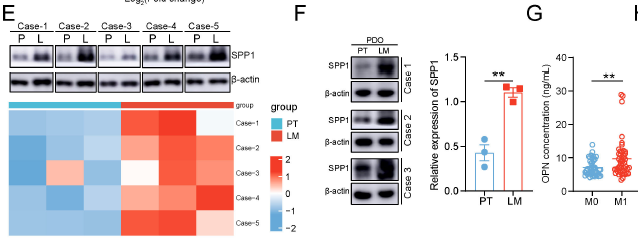
预后价值:
TCGA 数据显示,SPP1 高表达与 CRC 患者晚期 T/N 分期、短生存期相关。
临床样本验证:
CRLM 组织中 SPP1 蛋白水平较原发灶显著升高(Western blot,对应原文 Fig. 1E),患者血浆 SPP1 水平在转移组(M1)显著高于无转移组(M0)(ELISA,对应原文 Fig. 1G);
阐明 “SPP1-CAFs-CXCL12" 耐药机制
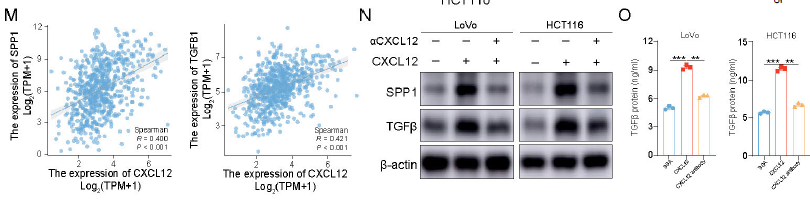
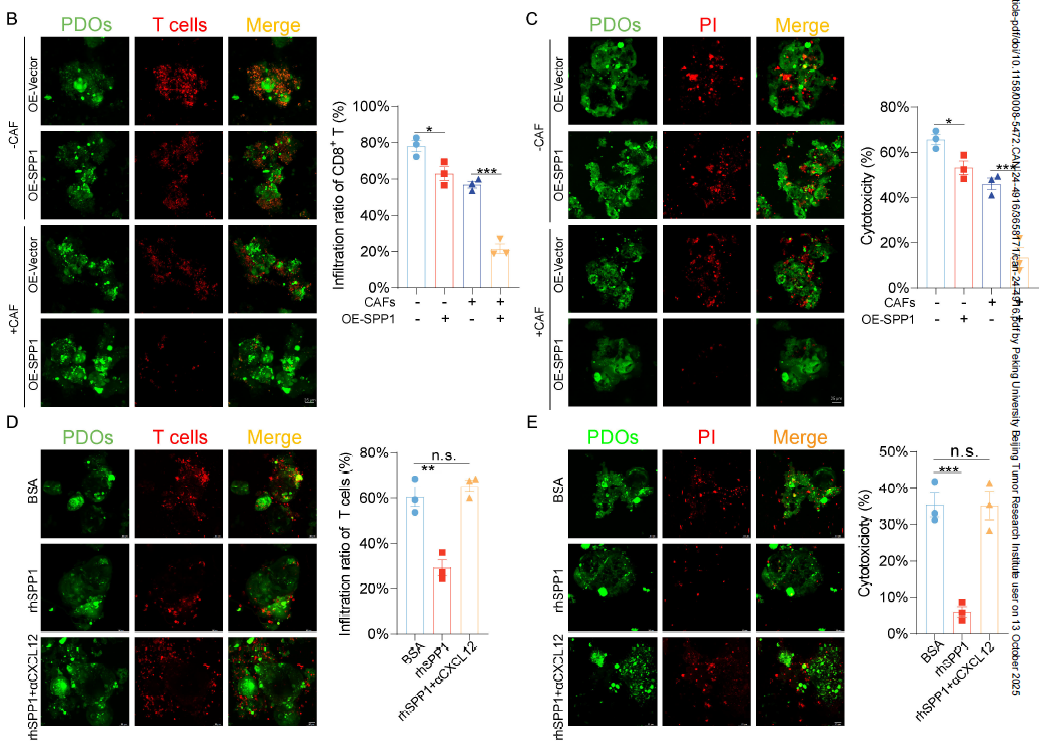
CXCL12 介导免疫抑制:
体外共培养实验显示,CXCL12 可显著减少 CD8+T 细胞向 PDO(患者来源类器官)的浸润,降低 T 细胞细胞毒性。
SPP1 旁分泌激活 CAFs:
SPP1 并非直接作用于肿瘤细胞,而是通过 “旁分泌" 激活 CAFs:SPP1 刺激 CAFs 分泌 CXCL12,CXCL12 反过来促进 CRC 细胞表达 SPP1 和 TGF-β,形成正反馈 loop;
验证多靶点靶向策略有效
靶向 CAFs:
talabostat(CAFs 抑制剂)可逆转 SPP1 诱导的胶原沉积和免疫抑制,显著提升抗 PD-1 疗效。
靶向 SPP1/CXCL12 轴:
抗 SPP1 抗体或 plerixafor(CXCR4 拮抗剂)联合抗 PD-1,可使 CRLM 小鼠肝转移灶减少 50% 以上(H&E 染色);
在这项研究中,Absin 的 Matrigel(货号:abs9490)作为关键基质材料,为 “盲肠原位肝转移模型" 的成功建立提供了核心支持 —— 该模型是模拟临床结直肠癌肝转移的 “金标准",能更真实反映肿瘤在体内的定植、侵袭和转移过程。
1. 产品应用场景:盲肠原位肝转移模型构建
研究团队在 “Establishment of cecal orthotopic liver metastasis with HCT116-HM" 章节明确指出:“HCT116-HM-luci 细胞被稀释至 4×10⁷ cells/mL 的 20% Matrigel(Cat# abs9490, Absin, Shanghai, China)中;麻醉 NOG 小鼠后,将 25μL 细胞悬液注射到盲肠壁,构建原位转移模型,术后通过活体成像监测肝转移情况。"
2. 产品核心作用:模拟体内微环境,保障模型可靠性
Matrigel 的主要成分是基底膜基质(含胶原蛋白 IV、层粘连蛋白等),其核心价值在于:
提供细胞定植 “土壤":
20% 的 abs9490 Matrigel 可模拟肠道黏膜下的基底膜结构,帮助 HCT116-HM 细胞在盲肠壁稳定附着、增殖,避免细胞注射后流失,确保原位肿瘤形成效率;
维持细胞恶性表型:
Matrigel 中的生物活性成分可维持 CRC 细胞的高转移特性,确保其能通过血行转移至肝脏,形成与临床相似的转移灶(对应原文 Fig. 8H-J 的活体成像和 H&E 染色结果);
保障实验重复性:
Absin abs9490 Matrigel 批次间稳定性高,为不同时间点、不同分组的模型构建提供了一致的微环境,使肝转移灶计数、治疗效果评估(如肿瘤信号强度、转移灶数量)更具统计学意义。
刘德胜团队的这项研究,不仅为 CRLM 的 “转移 - 耐药" 机制提供了全新解释(SPP1/CXCL12 轴),更验证了多靶点联合治疗的可行性,为临床转化奠定了基础。而 Absin 的 abs9490 Matrigel 作为关键实验工具,通过模拟体内微环境,确保了 “盲肠原位肝转移模型" 的真实性和可靠性,成为连接基础机制研究与临床治疗验证的重要桥梁。
对于致力于肿瘤转移、免疫治疗研究的科研者而言,选择高质量的 Matrigel(如 abs9490)可显著提升体内模型的构建效率和实验重复性。未来,Absin 也将持续为肿瘤、免疫、细胞生物学等领域提供更可靠的实验材料,助力更多科研成果的产出与转化!
| 货号 | 名称 | 规格 |
|---|---|---|
| abs9490 | 基质胶(标准型,含酚红) | 1.5mL×4/1.5mL×8 |
| 货号 | 商品名 | 规格 |
|---|---|---|
| abs9410 | 即用型基质胶 | 10mL/50mL/100mL |
| abs9490 | 基质胶(标准型,含酚红) | 1.5mL×4/1.5mL×8 |
| abs9491 | 基质胶(标准型,无酚红) | 1.5mL×8/1.5mL×4 |
| abs9492 | 基质胶(高浓度,含酚红) | 1.5mL×8 |
| abs9493 | 基质胶(高浓度,无酚红) | 1.5mL×8/1.5mL×4 |
| abs9494 | 基质胶(低因子,含酚红) | 1.5mL×4/1.5mL×8 |
| abs9495 | 基质胶(低因子,无酚红) | 1.5mL×8/1.5mL×4 |
| abs9496 | 基质胶(IPS验证无酚红) | 1.5mL×4 |
| abs9497 | 基质胶(高浓度,低因子,含酚红) | 1.5mL×8 |
| abs9498 | 基质胶(高浓度,低因子,无酚红) | 1.5mL×8 |

Absin产品线:
爆款产品:十da试剂盒(mIHC、IHC、凋亡、ELISA、ChIP、Co-IP、生化检测、残留检测、多因子检测);细胞培养(类器官试剂盒+基质胶,胎牛血清+培养添加剂+细胞因子)、分化试剂盒;分子(mRNA合成服务+提取试剂盒);化合物大包装;辅助试剂、耗材/仪器、定制服务(抗体/多肽/蛋白/标记/检测)...
特色产品:鸡胚提取物CEE、B27、N2、霍乱毒素B亚单位CTB、牛脑垂体提取物BPE、百日咳毒素PTX、重组人胰岛素Insulin、人源低密度脂蛋白LDL...